A Agência Nacional de Vigilância Sanitária (Ascoferj) publicou, na última sexta-feira (8/5), uma nota informando como deve ocorrer a notificação dos problemas identificados durante o uso dos testes para covid-19.
A prática é essencial, pois as informações recebidas formam um banco de dados que auxilia no planejamento e na execução de ações de inspeção, fiscalização e coleta de amostras para análises. Na nota, a Agência afirma que “o objetivo é manter o monitoramento contínuo dos produtos, visando a garantia da sua qualidade, segurança e eficácia”.
Confira os tipos de condições e links para cada relato:
– Produtos com registro RDC 36/2015 e RDC 348/2020: Queixa técnica / Evento adverso
– Produtos sem registro RDC 356 e 379/2020: Queixa técnica e evento adverso
– Denúncia: práticas comerciais fraudulentas, importação ou distribuição irregular
Orientações oficiais
A Anvisa tem uma área exclusiva no site com orientações e canais para o registro de notificações de queixas técnicas dos produtos para a saúde. As informações devem ser inseridas no Sistema de Notificação em Vigilância Sanitária (Notivisa).
Registro
A relação dos produtos regularizados para a detecção do novo coronavírus é atualizada diariamente e pode ser consultada no portal da Agência. A análise dos produtos segue as regras da RDC 348/2020, publicada em 18 de março, e que estabeleceu normas extraordinárias e temporárias para agilizar a avaliação dos pedidos de registro.
Os registros concedidos nas condições do artigo 12 dessa RDC têm validade de um ano. Já aqueles com base no artigo 11 e os que atendem aos requisitos da RDC 36/2015 têm validade de dez anos.
“É importante esclarecer que, para concessão desses registros, não são realizados ensaios laboratoriais prévios. A responsabilidade pelas informações prestadas à Anvisa é do detentor do registro do produto e o controle do desempenho da produção é previsto como preceito das boas práticas de fabricação”, informa a Anvisa no texto.
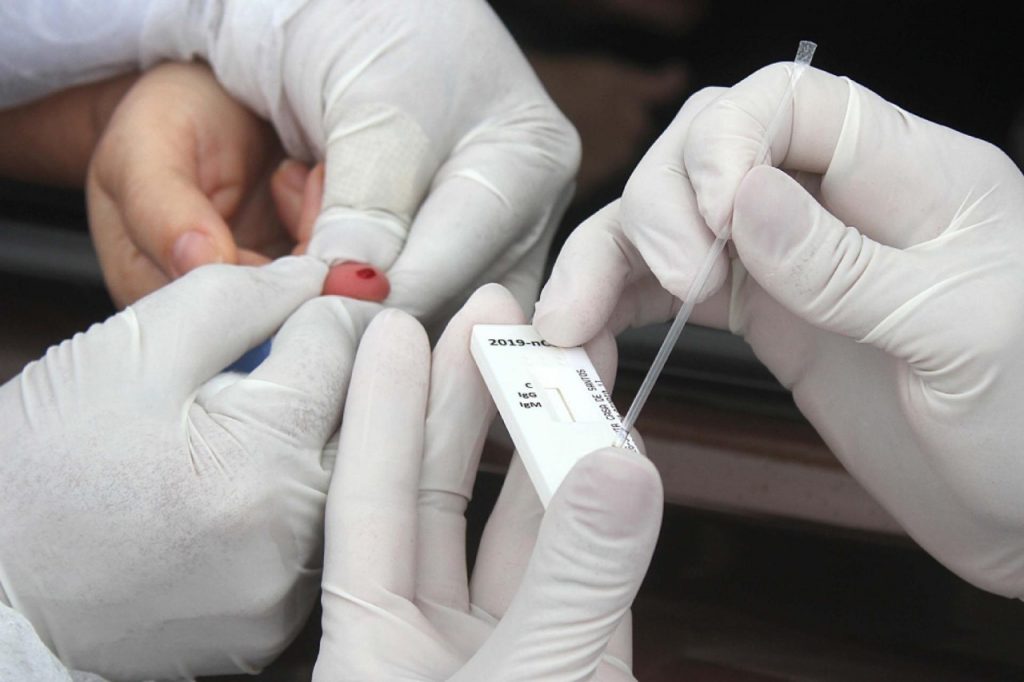
Testes rápidos
Tais produtos são de uso profissional e devem ser interpretados por profissionais de saúde, considerando informações clínicas, sinais e sintomas do paciente, além de outros exames. A Anvisa, o Ministério da Saúde e o Instituto de Qualidade em Saúde (INCQS/Fiocruz) instituíram um programa de monitoramento analítico para medir, por meio de ensaios laboratoriais feitos por cada uma das empresas fabricantes, o desempenho e a acurácia dos produtos.
Veja também: Como comprovar a qualidade dos testes rápidos de covid-19